on SANOFI-AVENTIS (EPA:SAN)
Sanofi renonce à l'autorisation de mise sur le marché du tolebrutinib dans le traitement de la SEP progressive primaire
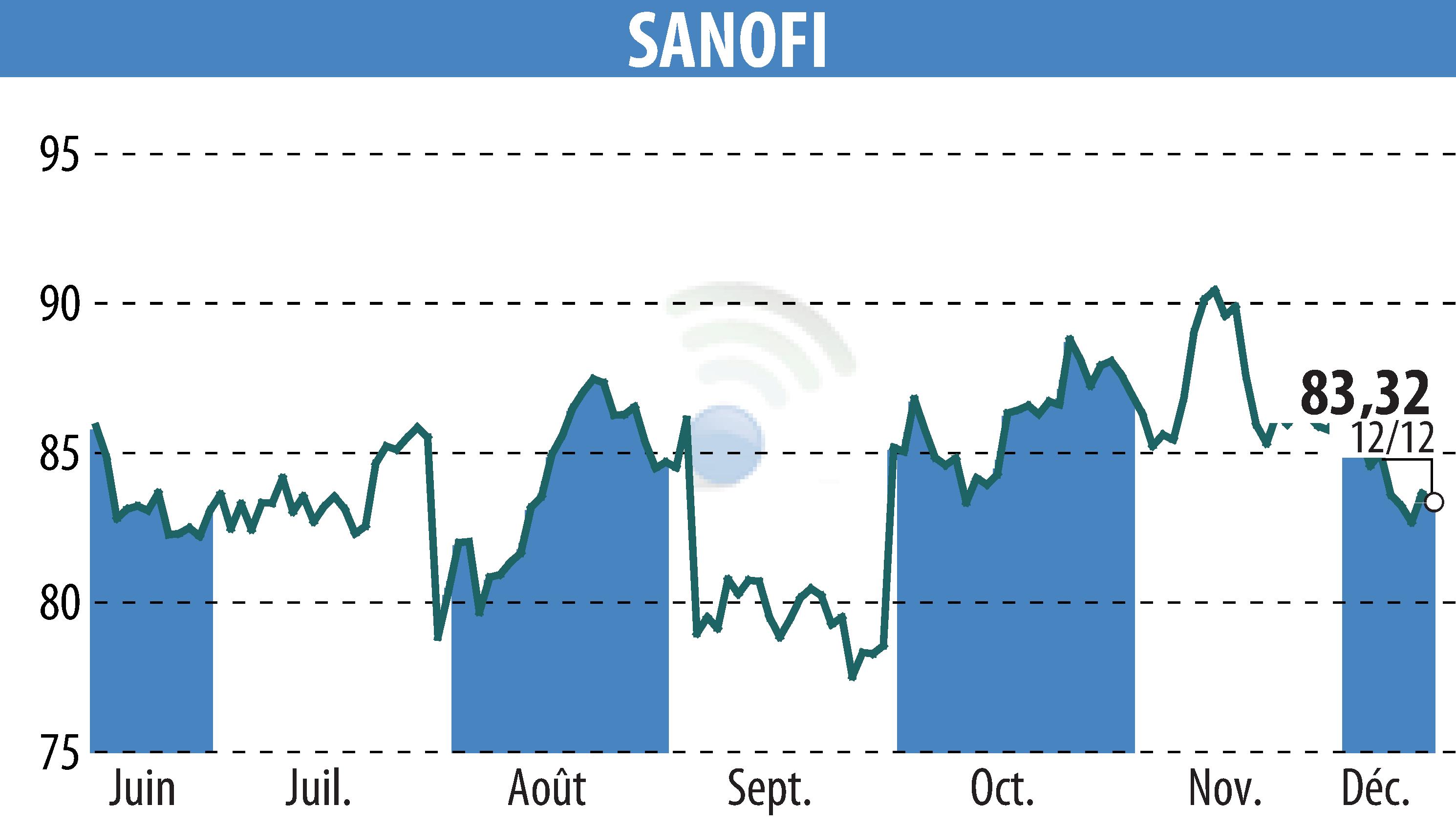
Sanofi a annoncé les résultats de son étude de phase 3 PERSEUS, indiquant que le tolebrutinib n'a pas atteint son critère d'évaluation principal, à savoir le ralentissement de la progression du handicap confirmée sur 6 mois chez les patients atteints de sclérose en plaques progressive primaire (SEP-PP). Par conséquent, Sanofi ne sollicitera pas d'autorisation de mise sur le marché pour ce médicament dans le traitement de la SEP-PP.
L'étude a confirmé que le profil de sécurité du tolébrutinib est conforme aux essais précédents ; toutefois, le risque d'atteinte hépatique médicamenteuse demeure, ce qui nécessite une surveillance étroite de la fonction hépatique. Les résultats complets, tant en termes de sécurité que d'efficacité, seront présentés lors d'un prochain congrès médical.
Malgré ce revers dans le traitement de la SEP progressive primaire (SEP-PP), le tolébrutinib a reçu une autorisation provisoire aux Émirats arabes unis pour la SEP-PP et fait actuellement l'objet d'un examen réglementaire dans d'autres régions. Sanofi prévoit de réaliser un test de dépréciation de la valeur de l'actif incorporel lié au tolébrutinib ; les résultats seront communiqués lors de la publication de ses résultats financiers du quatrième trimestre 2025.
R. H.
Copyright © 2026 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all SANOFI-AVENTIS news
