on SANOFI-AVENTIS (EPA:SAN)
Sanofi fait face à un retard dans l'approbation par la FDA du tolebrutinib pour le traitement de la SEP.
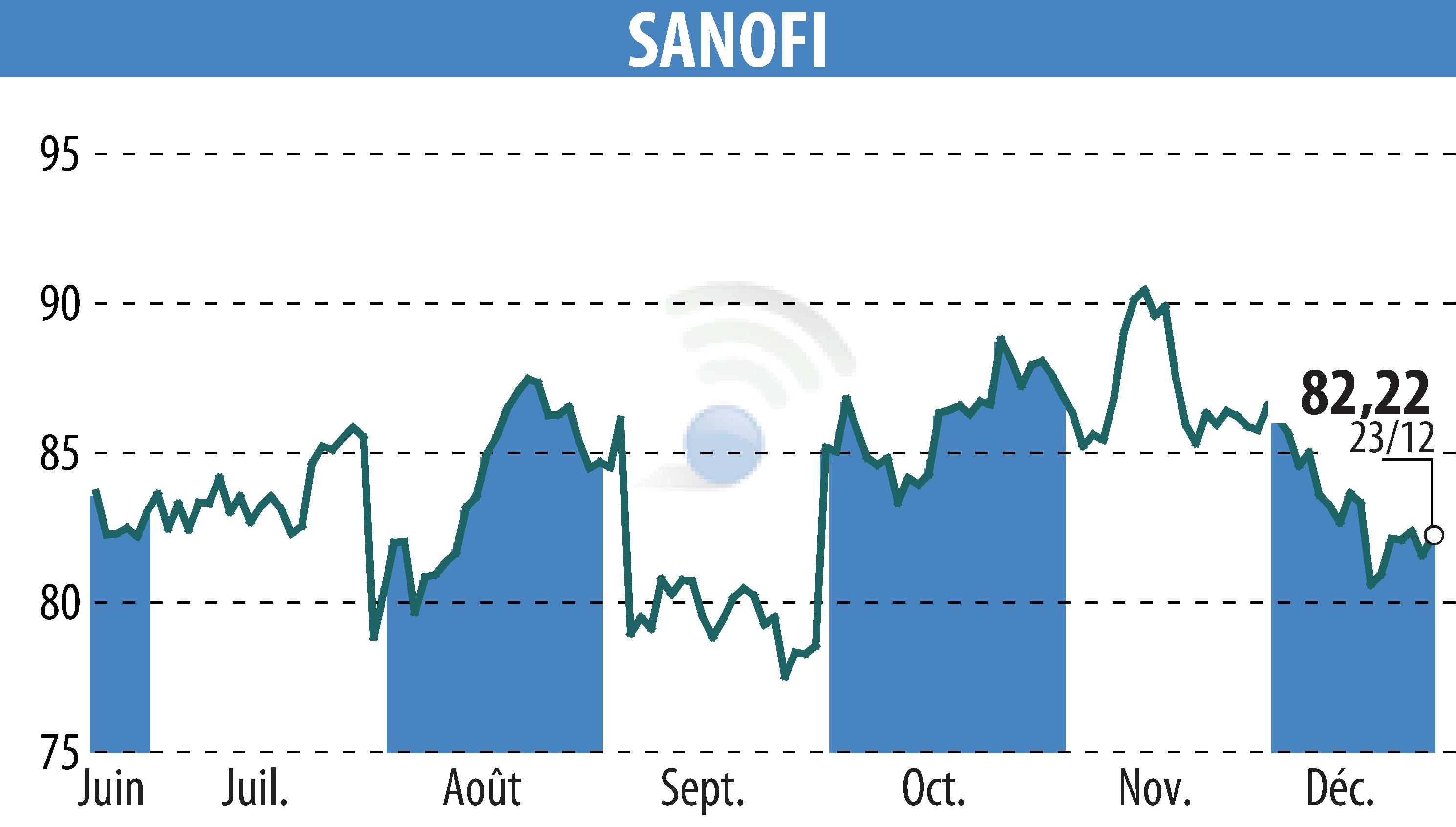
Sanofi a annoncé un report de sa demande d'autorisation de mise sur le marché pour le tolebrutinib, destiné au traitement de la sclérose en plaques secondaire progressive non rémittente (SEP-NR) chez l'adulte. La FDA américaine a émis une lettre de réponse complète concernant cette demande, prolongeant ainsi son examen au-delà de la date butoir initialement fixée au 28 décembre 2025. Sanofi prévoit de recevoir des précisions de la FDA d'ici la fin du premier trimestre 2026.
Malgré ce revers, Sanofi reste impliquée et a soumis un protocole d'accès élargi pour le médicament suite à la demande de la FDA. Le tolebrutinib a déjà reçu une autorisation provisoire aux Émirats arabes unis et est en cours d'évaluation réglementaire dans l'UE et d'autres régions. L'entreprise procède actuellement à un test de dépréciation de la valeur de l'actif incorporel lié au tolebrutinib, ce qui n'aura pas d'incidence sur ses prévisions financières pour 2025.
R. E.
Copyright © 2026 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all SANOFI-AVENTIS news
