on SANOFI-AVENTIS (EPA:SAN)
Le dépôt de la demande d'autorisation de mise sur le marché du tolebrutinib de Sanofi est retardé.
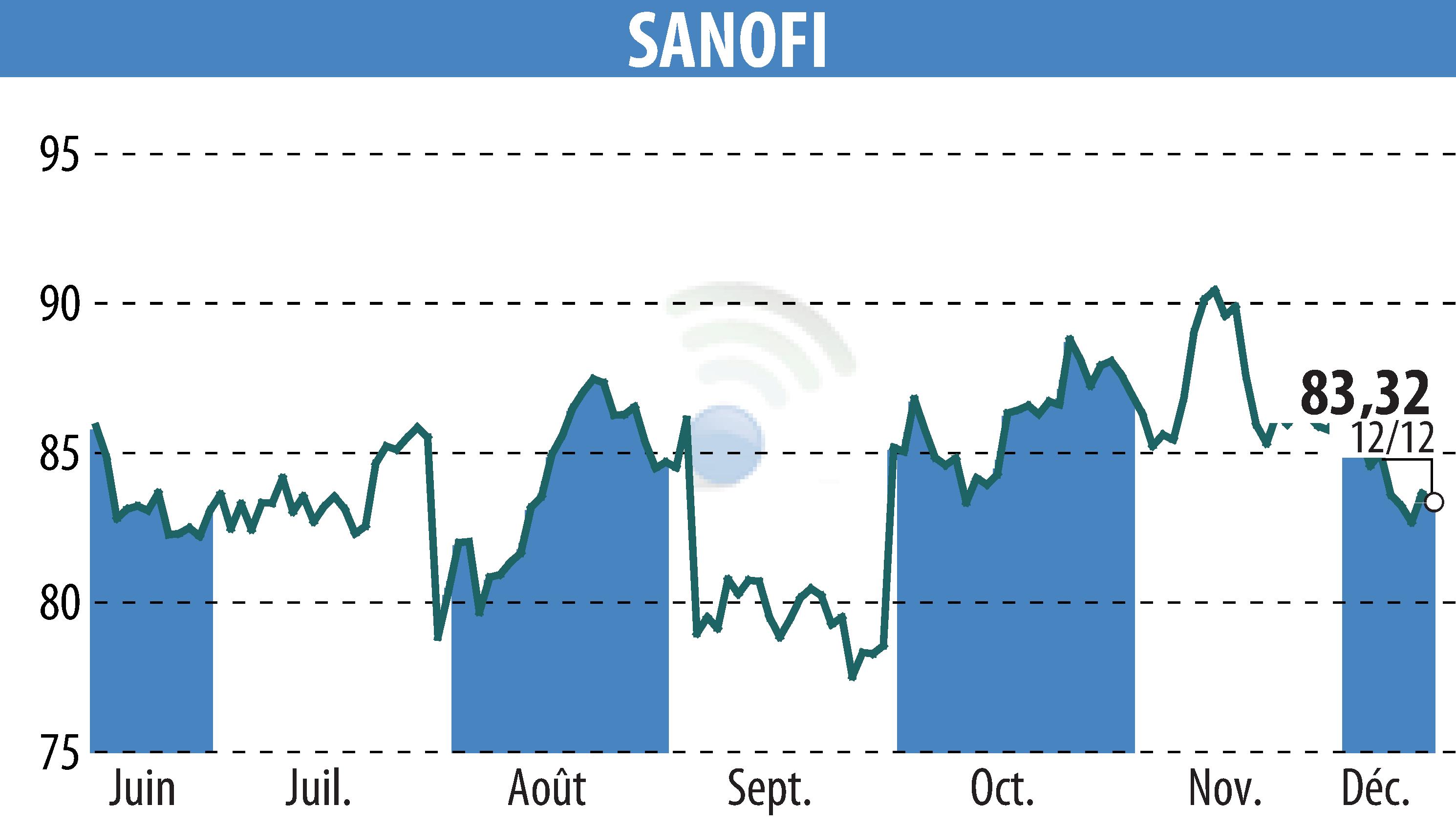
Sanofi a annoncé un report de la procédure d'évaluation réglementaire du tolebrutinib, destiné au traitement de la sclérose en plaques secondaire progressive non rémittente (SEP-NR). Initialement, une décision de la FDA était attendue pour le 28 décembre 2025 ; Sanofi prévoit désormais des précisions d'ici la fin du premier trimestre 2026. Ce report fait suite aux discussions en cours avec la FDA.
En réponse à une demande de la FDA, Sanofi a soumis un protocole d'accès élargi pour la SEP progressive secondaire non réfractaire (nrSPMS), témoignant ainsi de son engagement en faveur de l'accès des patients aux traitements. Malgré ce délai, Sanofi reste confiante quant aux bénéfices potentiels du tolébrutinib, qui cible spécifiquement la neuroinflammation, un facteur contribuant à la progression du handicap dans la sclérose en plaques.
Les discussions réglementaires en cours soulignent les efforts constants de Sanofi pour répondre à d'importants besoins médicaux non satisfaits dans le traitement de la sclérose en plaques et d'autres troubles neurologiques.
R. P.
Copyright © 2025 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all SANOFI-AVENTIS news
